鉅亨網記者 陳怡婷
浩鼎 (4174-TW) 自 2016 年 2 月解盲至今仍風風雨雨,睽違一年終於舉辦了法說會,目前各產品發展方向明朗。2018 年將開啟癌症疫苗 OBI-822 全球三期臨床,單株抗體 OBI-888 也將進入一期臨床試驗,其他包括二代疫苗 OBI-833、ADC 藥物 OBI-999、小分子藥物 OBI-3424 以及針對醣分子靶點 SSEA-4 的藥物皆陸續開展,公司產品線火力全開,發展方向已然明確。
浩鼎董事長張念慈表示,當初因 3/5 就要送美國臨床腫瘤醫學會(ASCO)發表,(2/19) 解盲後僅有 10 天可以分析實驗數據。一般來說,若只是一顆 me too 的藥 (如學名藥),像是 505(b)(2) 新藥分析大概僅需 3~6 個月,而一顆全新新藥 (First-in-class) 分析大約需要 1~2 年仔細分析資料,這次 OBI-822 經過將近兩年的資料分析和校正,在法說會上一次公布發現及進展。
當初解盲「初步」數據顯示,用藥組與對照組相比,主要療效指標 (primary endpoint) 未呈現統計學上顯著意義,外界認為這就是所謂的「解盲失敗」,但其中許多有意義的科學及臨床資訊,已為未來產品發展提供了明確的方向。
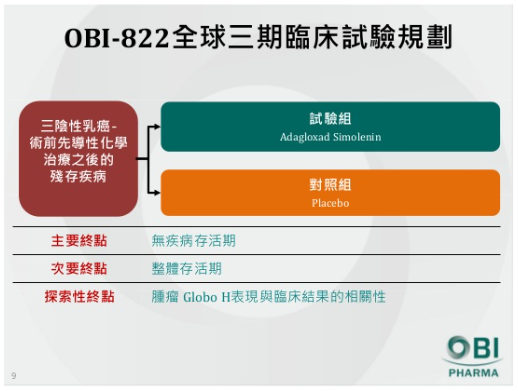
浩鼎的 OBI-822,在台灣屬二 / 三期合併臨床試驗,在全球則屬二期臨床試驗。解盲初步數據顯示,主要療效指標 (Primary endpoint) 未呈現統計學上顯著意義,但安全性並無重大疑慮,而且該試驗證實,病人透過主動免疫治療刺激產生 IgG、IgM 具有明確療效,證實 OBI-822 產生抗體的能力,由此浩鼎公司解盲後持續擴展產品線組合,由癌症主動免疫延伸到被動免疫療法,同時也引進非醣產品 (OBI-3424) 進入產品線。
首先要釐清的是,OBI-822 進度本就是全球人體臨床二期,又可將其視為樞紐性試驗,一般的人體臨床三期就是樞紐性試驗,因此當某款新藥的療效已經被確認,只要經過與主管機關討論,都有機會將第 2b 期人體臨床與第三期人體臨床試驗合併,好處是可加快臨床試驗進度。因此,實際上 OBI-822 在台灣屬二 / 三期合併臨床試驗解盲,並非一般的人體臨床三期解盲,這在意義上完全不同,更與基亞肝癌新藥 PI-88 人體臨床三期 (期中分析) 解盲完全不同。
另一方面,誠如鉅亨稍早推出的專題報導《初學者如何投資生技新藥篇?》指出,P 值<0.05 達顯著效果,並不等於療效好,由於 P 值對於療效大小並未加以描述,對於那些療效在統計上雖然不具顯著意義的資料 (即 P 值> 0.05),也沒有說明它們也可能暗示著某種程度的療效存在,意即 P 值代表的意義並非一翻兩瞪眼。
再看浩鼎近期主要進展,有兩大面向:
一是 OBI-822(又名為 Adagloxad Simolenin) 邁向全球三期臨床試驗。OBI-822 已於美國 FDA 及歐盟 EMA 完成有建設性的二期臨床試驗完成後會議,也在中國 CFDA 通過臨床試驗申請。
目前 OBI-822 全球三期臨床試驗預計今年第二季展開,規劃以找出引起主要免疫反應的生物標記為第一步,主要重點為:
不過,業內資深分析師表示,三陰性乳癌(triple negative breast cancer ,TNBC)意指雌激素受體(estrogen receptor,ER)、黃體素受體(progesterone receptor,PR)呈陰性,同時第二型人類表皮生長因子受體(HER2)未呈過度表現的乳癌。在乳癌的流行病學上,占乳癌總數約 15 至 20% 的三陰性乳癌,一直是屬於較難纏的癌症類型,不僅具有較高的轉移及復發機率,且好發於年輕患者(40 歲前),從開始發現到轉移的死亡率高且速度快,據研究統計,復發率高峰期約在治療後的一至三年。 因此,三陰性乳癌的患者收案較為不易,加上三期臨床試驗人數不少,恐怕收案時間較長。
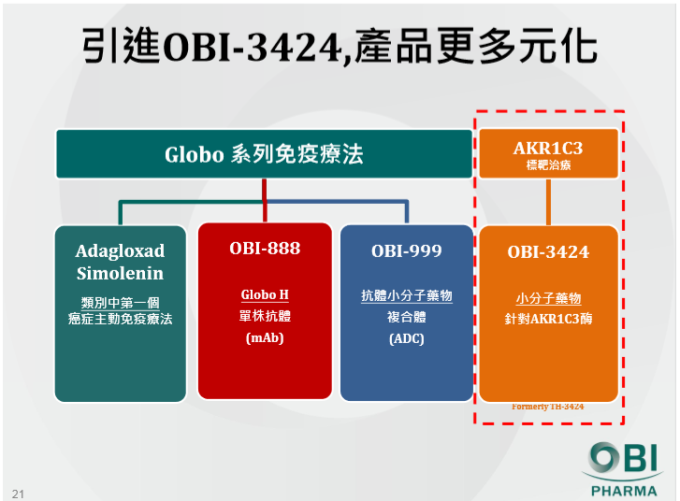
二是積極擴展產品線組合,主要技術平台包括醣疫苗、醣類抗體、抗體小分子複合物、雙特異性抗體與化療藥物的前驅物,鎖定的標的物為 Globo 系列衍生的 Globo H 與 SSEA4,由癌症主動免疫延伸到被動免疫療法,引進非醣產品 (OBI-3424) 進入產品線。由醣分子技術平台延伸至抗體相關產品,包括單株抗體及抗體小分子藥物複合體等,產品線含 A/S(OBI-822)、OBI-833、OBI-866、OBI-888、OBI-898、OBI-999 與 OBI-3424 等。
OBI-888 為具潛力的 Globo-H 抗體療法,全球癌症藥品市場也以單株抗體為主流。OBI-822 為瞄準 Globo-H 單株抗體,可以直接攻擊具有 Globo-H 表徵的癌細胞,用以治療無法透過 OBI-822 產生抗體反應的患者,目前進度已於人類腫瘤移植的動物實驗,包括乳癌、胰臟癌、胃癌、肺癌、大腸癌,規劃以胰臟癌和乳癌為主,已於 2017 年底送件申請人體臨床試驗 (IND)。
浩鼎公司表示,OBI-999 為具新穎標的 ADC 抗體小分子藥物複合體,具有高市場潛力及價值。根據生技中心預估,ADC 藥品巿場的未來巿場規模將維持二位數的成長率,2016~2022 年之複合年成長率(CAGR)將高達 21.8%,至 2022 年巿場規模將達到 47.8 億美元。
OBI-999 為 OBI-822 加上小分子藥物而成,屬於目前熱門的 ADC 藥物,透過單抗的專一性以及小分子的毒性來提升毒殺癌細胞效果,預計 2019 年申請人體臨床試驗 (IND)。
ADC 藥品因具有抗體藥物之專一性,且具有細胞毒殺的雙作用,在疾病治療上具有相當潛力,但是目前的技術在連結鏈接合抗體及腫瘤毒殺藥品之間的設計,是否為特異性或非特異性鏈結抗體,皆影響其藥效、安全及作用均一性。
雖然,現在臨床試驗中的 ADC 藥物越來越多,但因藥物需結合抗體、小分子藥物及連結鏈,複雜度高,加上進入人體後作用變數大,因此,在 ADC 藥品的未來發展具有一定挑戰性。
張念慈:ADC 藥物後發先至機會高!
張念慈表示,他認為 ADC 藥物最有機會後發先至。意即從藥物特性來看,不同於 OBI-822 以無惡化存活時間 (PFS, Progression Free Survival)(至少要觀察 2 年) 為主要觀察指標,單株抗體 OBI-888 是以客觀緩解率 (ORR, objective response rate) 為主要觀察指標,意即觀察腫瘤是否縮小,亦為近年來癌症治療臨床試驗設計方向,因此臨床試驗所需觀察時間較無疾病存活期 (DFS) 及總體活期 (OS)(至少要觀察 5 年) 來的短,OBI-888 有機會較 OBI-822 更早驗證 Globo-H 療效,為公司帶來價值。
浩鼎積極推進單株抗體 OBI-888 和 ADC 藥物 OBI-999 的進度,更為全面的覆蓋適用患者及適應症。在公司策略上 OBI-822 雖具有主動免疫療法的特色,且下一代癌症疫苗 OBI-833 也瞄準肺癌進入臨床試驗,雖仍需較長時間才能證明是否有癌症苗的價值,但也能夠充分發揮醣分子 Globo-H 的價值。此外,與圓祥生技合作的化療藥物前驅物的 OBI-3424,未來 5 年將聚焦在肝癌與 T 細胞急性白血病 (T-All),將於 2018 年第一季申請人體試驗臨床 (IND)。
至於浩鼎委託博謙生技製造生產公司研發的肉毒桿菌素新藥 OBI-858 臨床試驗藥品,博謙計劃將在半年內完成 OBI-858 廠房建造,預計一年內即完成臨床用藥物生產。
張念慈說,公司過去只有一個疫苗的時候,會比較惜售,現在看來全部東西都蠻有希望,公司策略有些變動,已經開始很積極地找合作夥伴,包括合資、共同開發、或臨床協助等可能模式都會去試。
「過去對禿鷹的突襲確實軟弱了些,但軟弱是因為上當,因為司法偵查不公開,導致公司一直挨打,以後會有秘密武器,知道怎麼應付了。」他直言說道。
公司未來五年策略發展重點,包括積極進行 OBI-822 全球三期臨床試驗、加速發展 Globo Series Mab/ADC、加速發展 OBI-3424 在肝癌及 T-ALL,以及鞏固商業授權 / 或科研合作,將極大化產品線價值。
上一篇
下一篇
